Για να απαντήσουμε σ’ αυτήν την ερώτηση πρέπει να σκεφτούμε λίγο αυτά που είπε ο Arrhenius.
Ένα οξύ όταν διαλυθεί στο νερό δίνει Η+ άρα όσα περισσότερα Η+ έχει ένα διάλυμα (σε δεδομένο όγκο) θα είναι πιο όξινο.

Για να μπορέσουμε να άμεσα να μετρήσουμε πόσο όξινο είναι ένα διάλυμα χρησιμοποιούμε την κλίμακα του pH. Όσο μικρότερο το pH ενός διαλύματος τόσο πιο όξινο είναι αυτό.
Τα όξινα δ/τα έχουν pH <7

Η παραπάνω κλίμακα εφαρμόζεται για τη θερμοκρασία των θ=250 C
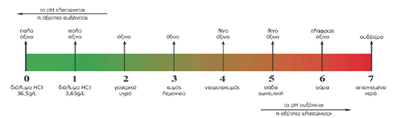
Ποιο το pH του καθαρού νερού ;
Στο καθαρό νερό υπάρχει πολύ μικρός αριθμός Η+ τα οποία προέρχονται από : H2O → H+ + OH-
Ο αριθμός Η+ = αριθμό OH-
Το pH του καθαρού νερού σε θ=250 C είναι ίσο με 7 (pH=7). Τα διαλύματα που έχουν pΗ=7 ονομάζονται ουδέτερα δ/τα.
Στα όξινα δ/τα υπερισχύουν τα Η+ σε σχέση με τα OH- . Δηλαδή ισχύει : αριθμός Η+ >αριθμός OH- και pH<7.
Αν προσθέσουμε νερό (αραίωση) σ’ ένα όξινο δ/μα το pH του αυξάνεται και τείνει προς το 7.
Μέτρηση του pH ενός δ/τος.
Η μέτρηση το pH ενός δ/τος γίνεται με :
Ι. Δείκτες

ΙΙ. πεχαμετρικά χαρτιά
ΙΙΙ. πεχάμετρο ( ακριβέστερα αποτελέσματα).

Δ1: δ/μα με pH=3 και Δ2: δ/μα με pH=2 .
α. Ποιο από τα δύο δ/τα είναι πιο όξινο ; Τι εννοούμε όταν λέμε ότι το δ/μα είναι πιο όξινο σε σχάση με ένα άλλο;
β. Σε ποιο από τα δύο δ/τα πρέπει να προσθέσουμε νερό έτσι ώστε να αποκτήσουν και τα δύο δ/τα την ίδια τιμή pH;
Όλα τα δ/τα έχουν θ=250C.
2. Να γίνει η αντιστοίχηση μεταξύ των δ/των της στήλης Α με τα pH της στήλης Β (θ=250C)
Στήλη Α | Στήλη Β |
1. Αραιό δ/μα ΗCℓ | 1 |
2. πυκνό δ/μα ΗCℓ | 3 |
3. πολύ αραιό δ/μα ΗCℓ | 5 |
7 | |
12 |








